Bảng nguyên tử khối hóa học thì Brom có nguyên tử khối bao nhiêu? Đây là những câu hỏi thường gặp khi học sinh gặp phải dạng bài tập này, để làm bài tập nhanh chóng các bạn cần nhớ nguyên tử khối của Brom điều này thực sự cần thiết nhé!
Nguyên tử khối của Brom (Br)
Trong bảng tuần hoàn hóa học, Brom có:
- Ký hiệu là: Br
- Số Proton của Brom: 35
- Nguyên tử khối của Brom: 80
- Brom có hóa trị: I,…
Hai đồng vị ổn định của brom là: Br79 (50,69%) và Br81 (49,31%).
Nhiệt độ nóng chảy: 265,8 K
Nhiệt độ sôi: 332,0 K
Nhiệt độ bay hơi: 29.96 kJ·mol−1
Brom tan ít trong nước nhưng tan nhiều trong các dung môi hữu cơ như etanol, benzen, xăng,…
Tính chất hóa học của Brom
Brom, còn gọi là brôm, có ký hiệu hóa học là Br, thuộc nhóm Halogen. Brom là chất lỏng màu đỏ nâu, mùi khó chịu, dễ bay hơi, có tính độc. Brom là chất ôxi hóa yếu hơn clo.
Brom có các tính chất hóa học sau:
1- Br tác dụng với hidro
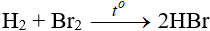
Độ hoạt động giảm dần từ Cl → Br → I
Các khí HBr, HI tan vào nước tạo dung dịch axit.
Về độ mạnh axit thì lại tăng dần từ HCl < HBr < HI.
2- Br tác dụng với kim loại
Tạo muối tương ứng
3- Tính khử của Br2, HBr
Brom thể hiện tính khử khi gặp chất oxi hóa mạnh (như nước clo, …)
Br2 + 5Cl2 + 6H2O → 2HBrO3 (Axit bromic) + 10HCl
Tính khử của HBr (ở trạng thái khí cũng như trong dd) mạnh hơn HCl. HBr khử được H2SO4 đặc thành SO2.
2HBr + H2SO4đ → Br2 + SO2 + 2H2O
Dd HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dd HF và HCl không có phản ứng này):
4HBr + O2 → 2H2O + 2Br2
Kết luận
Hi vọng bài viết trên Tài Liệu Trọn Đời sẽ giúp ích được các em hiểu hơn về nguyên tố hóa học Brom nhé!