Mangan, viết tắt hóa học là Mn, là một loại kim loại có màu trắng xám, tương tự như sắt. Nó có tính chất cứng và dễ vỡ, khó tan chảy, nhưng lại dễ bị ôxy hóa. Tuy nhiên, chỉ sau khi trải qua quá trình xử lý đặc biệt, mangan mới trở thành kim loại.
Khi ai đó hỏi “M của Mn bao nhiêu?”, “Mn có hóa trị mấy?”, họ thực sự muốn biết về số lượng hóa trị có thể có của nguyên tố này. Để hiểu rõ hơn vấn đề này, hãy đọc bài viết dưới đây cùng với Tài Liệu Trọn Đời nhé!
Mn hóa trị mấy? M của Mn bao nhiêu?
Đáp án:
+ Mangan có thể có các hóa trị II, IV và VII.
+ Nguyên tử khối của Mn là 55 g/mol.
Ngoài ra Mn có các thông tin trong bảng tuần hoàn như sau:
+ Mn có 25 proton, thuộc nhóm VIIB và chu kỳ 4.
+ Cấu hình electron của mangan là 1s22s22p63s23p63d54s2 hoặc [Ar] 3d54s2.
+ Số hiệu nguyên tử của Mangan là 25
+ Mangan có các đồng vị gồm 52Mn, 53Mn, 54Mn và 55Mn.
+ Các số OXH phổ biến của Mangan là +2, +3, +4, +6 và +7.
+ Khối lượng riêng của Mangan là 7,44 g/cm3.
+ Nhiệt độ nóng chảy của Mangan là 1245 0C
+ Nhiệt độ sôi là 2080 0C.
Một số thông tin về Mangan (Mn)
Mangan, viết tắt hóa học Mn, là một loại kim loại có màu trắng xám, tương tự như sắt. Nó có tính chất cứng và dễ vỡ, khó tan chảy, nhưng lại dễ bị ôxy hóa. Tuy nhiên, chỉ sau khi trải qua quá trình xử lý đặc biệt, mangan mới trở thành kim loại.
Mangan là một trong những nguyên tố phổ biến nhất được tìm thấy trong vỏ Trái Đất, chiếm khoảng 1000 ppm (0,1%) tổng hợp. Nó được xếp thứ 12 trong số các nguyên tố phổ biến nhất trên Trái Đất. Trên trung bình, đất chứa khoảng 440 ppm mangan, trong khi nước biển chỉ chứa 10 ppm mangan và trong khí quyển là 0,01 µg/m3.
Tính chất hóa học của Mangan
Mangan là một nguyên tố có nhiều trạng thái ôxi hóa phổ biến như +2, +3, +4, +6 và +7. Tuy nhiên, trạng thái ôxi hóa ổn định nhất của Mangan là +2.
Tương tác với phi kim
Mangan có khả năng tác động trực tiếp lên nhiều phần tử phi kim.
Mn (bột) + O2 → MnO2 (tự bốc cháy)
Mn + Cl2 → MnCl2
Tương tác với axit
- Khi mangan tương tác với axit clohidric (HCl) và axit sunfua (H2SO4) loãng:
Mn (bột) + 2HCl (loãng) → MnCl2 + H2
- Khi mangan tương tác với axit nitric (HNO3) và axit sulfuric đặc (H2SO4),
Mn + 2H2SO4 (đặc) → MnSO4 + SO2 + 2H2O
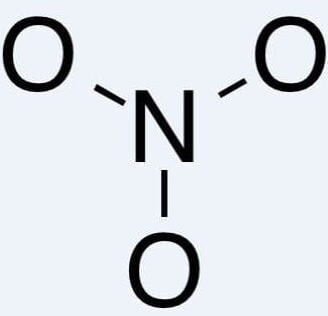
3Mn + 8HNO3 (loãng, nóng) → 3Mn(NO3)2 + 2NO + 4H2O
Tương tác với nước
Mn (bột) + 2H2O (hơi) → Mn(OH)2 + H2