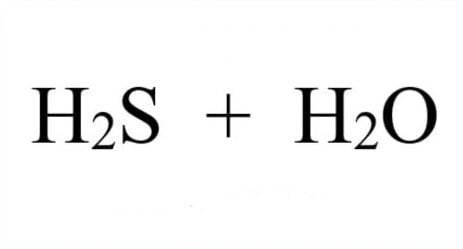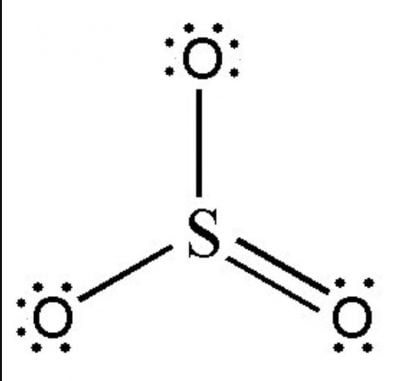
Trong lĩnh vực hóa học, công thức SO3 thường được sử dụng trong các bài tập để xác định hóa trị của axit. Nhưng SO3 thực sự là gì? Hóa trị của nó là bao nhiêu? Bài viết sau sẽ giúp bạn hiểu hơn về hóa trị của SO3, còn được biết đến dưới tên gọi khác là lưu huỳnh trioxit.
Gốc SO3 hóa trị mấy?
SO3 thuộc nhóm nguyên tử có hóa trị II
Ngoài ra, SO3 cũng được coi là một oxit axit, phản ứng với nước tạo ra axit sulfuric và phản ứng với bazơ tạo ra muối.
Khi tác động vào H2O: SO3 + H2O → H2SO4
SO3 cũng hòa tan hoàn toàn trong H2SO4, tạo ra oleum H2SO4.nSO3.
Khi tác động vào NaOH: SO3 + 2NaOH → Na2SO4 + H2O
SO3, hoặc lưu huỳnh trioxit, thường tồn tại dưới dạng chất lỏng không màu ở điều kiện thường. Nhiệt độ nóng chảy là 17ºC và nhiệt độ sôi là 45ºC. Đặc biệt, SO3 hoàn toàn hòa tan trong nước và axit H2SO4.
Tính chất hóa học của SO3
SO3 là một oxit axit, khi phản ứng với nước, tạo thành dung dịch axit mạnh – H2SO4.
SO3 + H2O → H2SO4
Tác dụng với bazơ
SO3 có thể phản ứng với dung dịch bazơ, tạo ra các loại muối khác nhau như sulfate và hydrosulfate.
– SO3 + KOH → KHSO4
– SO3 + 2KOH → K2SO4 + H2O
– SO3 + NaOH → Tùy theo tỉ lệ, tạo ra muối axit hydrosulfate (chứa ion HSO4-) hoặc muối trung hòa sulfate (chứa ion SO42-).
Tác dụng với oxit bazơ
Khi phản ứng với oxide bazơ, SO3 tạo ra muối như sau:
SO3 + BaO → BaSO4
Bài viết trên hy vọng đã giúp bạn hiểu rõ hơn về SO3 và các phản ứng hóa học đặc biệt của nó! Nếu có câu hỏi, đừng ngần ngại đặt ra. Hãy cùng khám phá thêm về thế giới hóa học!