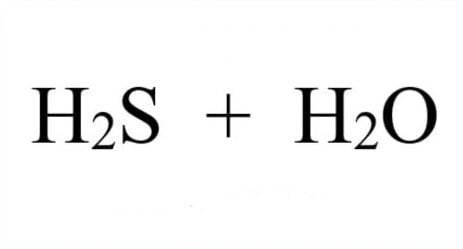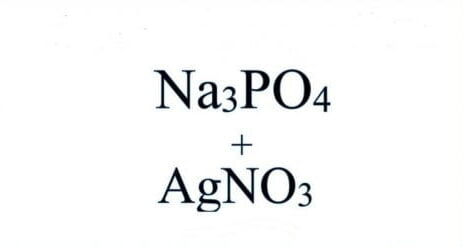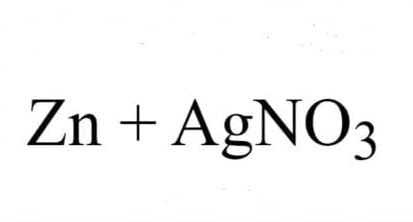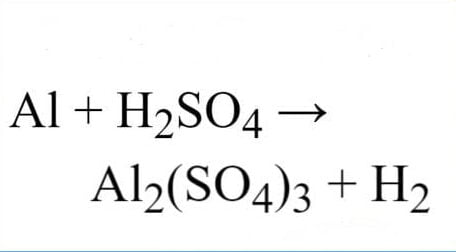Trải qua bài viết này, mình muốn chia sẻ với các bạn về thông tin căn bản về lưu huỳnh trong bảng tuần hoàn hóa học. Cùng nhau tìm hiểu về S hóa trị mấy, nguyên tử khối của S và phân tử khối của nguyên tố S nhé.
Lưu huỳnh – S hóa trị mấy? Nguyên tử khối của S là bao nhiêu?
- Nguyên tử khối: 32
- Hóa trị của lưu huỳnh: II, IV, VI
Ngoài ra, trên bảng tuần hoàn hóa học, lưu huỳnh được biểu diễn bằng ký hiệu “S” và có các thông số sau:
- Số proton: 16
- Vị trí: Ô thứ 16, thuộc chu kỳ 3 và nhóm VIA
- Cấu hình electron: 1s²2s²2p⁶3s²3p⁴
- Độ âm điện: 2,58
Lưu huỳnh nằm ở ô thứ 16 trên bảng tuần hoàn, thuộc chu kỳ 3 và nhóm VIA. Cấu hình electron của lưu huỳnh là 1s²2s²2p⁶3s²3p⁴, cho thấy có tổng cộng 16 electron phân bố vào các năng lượng và vùng không gian khác nhau.
Độ âm điện của lưu huỳnh là 2,58, cho thấy tính chất điện âm trung bình. Điều này có nghĩa là lưu huỳnh có khả năng tương tác với các nguyên tử khác để tạo ra liên kết hóa học.
Lưu huỳnh (S) – Chất gì?
Lưu huỳnh, hay còn gọi là sulfur, là một nguyên tố hóa học có ký hiệu S và số nguyên tử là 16. Trong cơ thể, lưu huỳnh đóng vai trò quan trọng trong các axit amin.
Trong lĩnh vực công nghiệp, lưu huỳnh được sử dụng nhiều trong phân bón, thuốc súng, diêm, thuốc trừ sâu và thuốc diệt nấm. Nó là một phi kim phổ biến, không màu, không mùi và có nhiều hóa trị. Thường tồn tại ở dạng chất rắn màu vàng chanh.
Trên tự nhiên, lưu huỳnh có thể được tìm thấy dưới dạng nguyên chất hoặc trong khoáng chất sulfua và sulfat. Đáng lưu ý, mùi khó chịu của lưu huỳnh giống mùi trứng thối, chính là mùi của hydro sunfua (H2S).
Tính chất hóa học của Lưu huỳnh (S)
Lưu huỳnh có khả năng oxi hóa khi tiếp xúc với kim loại và hidro.
Khi phản ứng với hidro, lưu huỳnh tạo ra khí hidro sulfua (H₂S) ở nhiệt độ 350°C theo phương trình: H₂ + S → H₂S.
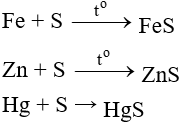
Trên mặt khác, khi phản ứng với kim loại, lưu huỳnh tạo ra các sản phẩm có số oxi hóa thấp của kim loại.
Lưu huỳnh và oxi kết hợp để tạo thành hợp chất lưu huỳnh điôxit (SO2), ví dụ về phản ứng oxi hóa-khử xảy ra ở nhiệt độ thường.
Lưu huỳnh có tính khử trong phản ứng này, trong khi oxi có tính oxi hóa. Điều này giúp lưu huỳnh khử các chất độc như thủy ngân.
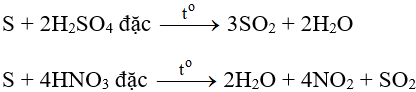
Lưu huỳnh tương tác với các chất oxi hóa mạnh.
Kết luận
Chúng ta đã cùng tìm hiểu về tầm quan trọng của lưu huỳnh trong lĩnh vực hóa học. Hy vọng rằng bạn đã hiểu rõ về S hóa trị mấy và nguyên tử khối của S là bao nhiêu. Nếu còn thắc mắc gì, hãy để lại bình luận dưới đây, mình sẽ chia sẻ thêm thông tin cho bạn. Cảm ơn bạn đã đọc bài viết!