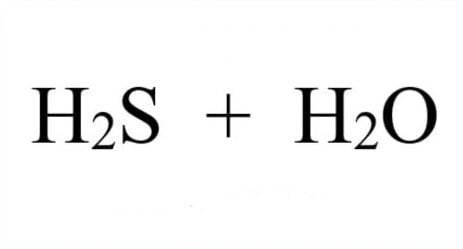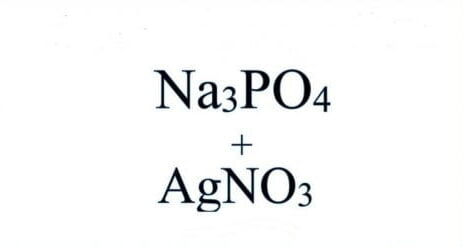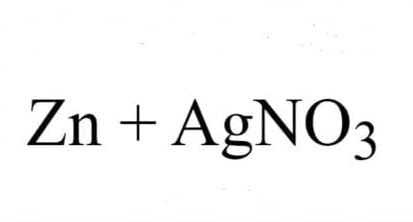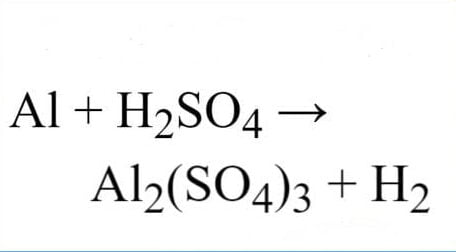Bạn có thắc mắc điều gì xảy ra khi sắt (Fe) tiếp xúc với axit sulfuric (H2SO4)? Bài viết này sẽ giải thích chi tiết về phản ứng thú vị này, phụ thuộc vào nồng độ và nhiệt độ của axit. Chúng ta sẽ đi sâu vào hiện tượng quan sát được, sản phẩm tạo thành và cả những ứng dụng thực tế của phản ứng Fe + H2SO4 loãng.
Tổng quan về phản ứng Fe + H2SO4
Trước khi đi sâu vào chi tiết, hãy cùng tìm hiểu đôi nét về sắt (Fe) và axit sulfuric (H2SO4). Sắt là một kim loại phổ biến, có mặt trong nhiều hợp chất và vật liệu xung quanh chúng ta. Axit sulfuric, còn được gọi là vitriol, là một axit mạnh có nhiều ứng dụng trong công nghiệp.
Phản ứng giữa Fe và H2SO4 có thể diễn ra theo các cách khác nhau tùy thuộc vào nồng độ và nhiệt độ của axit. Nồng độ của axit được ký hiệu là [concentration], thường được biểu thị bằng molarity (M) – số mol chất tan trong một lít dung dịch. Nhiệt độ phản ứng được ký hiệu là [temperature] và thường được đo bằng độ C (°C).
Hiện tượng phản ứng Fe + H2SO4

Phản ứng Fe + H2SO4 loãng
Thử nghiệm với sắt và axit sulfuric loãng là một thí nghiệm hóa học kinh điển. Khi thả một mẩu sắt vào dung dịch axit sulfuric loãng, bạn sẽ thấy bọt khí ngay lập tức thoát ra xung quanh mẩu sắt. Bọt khí này chính là khí hydro (H2). Đồng thời, dung dịch dần chuyển sang màu vàng nhạt.
Hãy cùng giải thích hiện tượng này bằng phương trình hóa học. Trong phản ứng này, sắt (Fe) đóng vai trò là chất khử, mất electron và chuyển thành sắt(II) (Fe2+). Axit sulfuric (H2SO4) đóng vai trò là chất oxi hóa, nhận electron và tạo thành ion sulfat (SO42-). Phương trình hóa học của phản ứng Fe + H2SO4 loãng được viết như sau:
Fe (s) + H2SO4 (aq) → FeSO4 (aq) + H2 (g)
- (s) thể rắn, (aq) dung dịch, (g) khí
Phản ứng Fe + H2SO4 đặc nguội (tính thụ động của sắt)
Điều thú vị là sắt lại không phản ứng với axit sulfuric đặc nguội. Hiện tượng này được gọi là tính thụ động của sắt. Khi tiếp xúc với axit sulfuric đặc nguội, bề mặt của sắt bị bao phủ bởi một lớp màng mỏng oxit sắt (Fe2O3). Lớp màng này ngăn cản sắt tiếp xúc trực tiếp với axit, do đó phản ứng không xảy ra.
Phản ứng Fe + H2SO4 đặc nóng
Khi đun nóng axit sulfuric đặc, tính thụ động của sắt bị phá vỡ. Lúc này, sắt phản ứng mãnh liệt với axit, giải phóng khí sulfur dioxide (SO2) có mùi hắc. Phương trình hóa học của phản ứng Fe + H2SO4 đặc nóng có thể được viết như sau:
2Fe (s) + 3H2SO4 (đặc, nóng) → Fe2(SO4)3 (aq) + 3SO2 (g) + 6H2O (l)
- (đặc, nóng) đặc, đun nóng, (l) chất lỏng
Sản phẩm của phản ứng Fe + H2SO4
Sản phẩm của phản ứng Fe + H2SO4 phụ thuộc vào nồng độ và nhiệt độ của axit.
- Phản ứng Fe + H2SO4 loãng tạo ra sắt(II) sunfat (FeSO4) và khí hydro (H2).
- Phản ứng Fe + H2SO4 đặc nóng tạo ra sắt(III) sunfat (Fe2(SO4)3), khí sulfur dioxide (SO2) và nước (H2O).
Ứng dụng của phản ứng Fe + H2SO4
Phản ứng Fe + H2SO4 có một số ứng dụng quan trọng trong đời sống.
- Ngành công nghiệp hóa học: Phản ứng này được sử dụng để sản xuất sắt(II) sunfat, một hóa chất được dùng trong nhiều ngành công nghiệp, chẳng hạn như sản xuất thuốc nhuộm, mực in và chất xúc tác.
- Pin sắt-axit sulfuric: Pin sắt-axit sulfuric lưu trữ năng lượng trong hai dung dịch riêng biệt: dung dịch sắt(II) sunfat (FeSO4) và dung dịch axit sulfuric (H2SO4). Bên trong pin, hai dung dịch này được lưu thông qua một ngăn chứa điện phân (cell).
Kết luận
Phản ứng Fe + H2SO4 là một phản ứng hóa học thú vị, diễn biến theo các cách khác nhau tùy thuộc vào nồng độ và nhiệt độ của axit. Bài viết đã cung cấp thông tin chi tiết về hiện tượng quan sát được, sản phẩm tạo thành và ứng dụng của phản ứng này. Hy vọng bài viết giúp bạn hiểu hơn về thế giới của phản ứng hóa học!